Teknologier for unik enhetsidentifikasjon automatiserer medisinsk ID- og strekkodelesing
Bidrag fra DigiKeys nordamerikanske redaktører
2023-10-26
I 2013 implementerte US Food and Drug Administration (FDA) Unique Device Identification System eller UDI-regelen. Regelen hadde som mål å forbedre pasientsikkerhet ved å tilby en konsistent metode for sporing og identifisering av medisinsk utstyr ved å bruke moderne dokumentasjon ved produksjons-, distribusjons- og brukspunkter. I likhet med forskriftskravene for medisinsk utstyr i Europa eller lignende forskrifter i andre land, forbedrer den amerikanske UDI-regelen rapporteringsnøyaktigheten og forenkler analyse i tilfelle en tilbakekalling eller ugunstig hendelse skulle oppstå.
Fra og med 24. september 2023 vil FDA fullt ut håndheve National Health Related Item Code og Drug Code Numbers på enheters etiketter og innpakninger. Alle medisinske produkter som er merket på eller etter denne datoen, må være i full overensstemmelse med UDI-mandatene. Dette mandatet vil påvirke følgende:
- Livskritiske produkter i klasse 3, for eksempel pacemakere og implanterte proteser
- Moderat kritiske produkter i klasse 2, slik som sprøyter, katetre og absorberbare suturer
- Produkter i klasse 1 med lavere risiko, for eksempel tanntråd, medisinske frakker og oksygenmasker
Full håndheving av mandatet betyr at hvis en medisinsk komponent ikke har noen skannbar strekkode, vil den ikke lenger betraktes som et gyldig/brukbart produkt, selv om det er menneskelesbare etiketter på det, og selv om produktet generelt antas å være lett identifiserbart av de fleste brukere. Denne håndhevelsen vil tilskynde omfattende innføring fra den medisinske industrien og medisinsk forsikringsfakturering.
 Figur 1: Noen håndholdte DPM-strekkodeverifikatorer (DPM – Direct Part Mark) har avansert belysning og annen programvare som automatisk finner symboler og blar gjennom innstillingene for å optimalisere avlesningen av det spesifikke DPM-merket og aktuelle materialunderlaget. LVS-9585 som vises her, kan faktisk bekrefte både DPM-deler og trykte etiketter for omfattende analyse og rapportering. (Bildekilde: Omron Automation)
Figur 1: Noen håndholdte DPM-strekkodeverifikatorer (DPM – Direct Part Mark) har avansert belysning og annen programvare som automatisk finner symboler og blar gjennom innstillingene for å optimalisere avlesningen av det spesifikke DPM-merket og aktuelle materialunderlaget. LVS-9585 som vises her, kan faktisk bekrefte både DPM-deler og trykte etiketter for omfattende analyse og rapportering. (Bildekilde: Omron Automation)
Oppdragsgiver (merkevarebærer) er ansvarlig
I USA er IP-eieren og den brukervendte merkevaren til hvert medisinske produkt ansvarlig for nøyaktigheten og kvaliteten til UDI-koder. Dette er spesielt viktig siden så mye av markedet for medisinske produkter er kontraktprodusert og outsourcet til andre organisasjoners anlegg. Derfor er det organisasjonen med kontrakten sitt ansvar å sikre at hele forsyningskjeden er UDI-kompatibel og produserer nøyaktige etiketter.
Opprinnelse til teknologi for unik enhetsidentifikasjon (UDI)
UDI-er er statiske enhetsidentifikatorer. Endringer i antall varer i en pakke kan imidlertid utløse et behov for en ny identifikator. Utstedende byråer dikterer hvordan disse detaljene skiller seg ut. På samme måte kan endring av en enhets emballeringssterilitet også endre enhetsidentifikatoren. Endring av en enhets destinasjonsmarked (landet der en enhet skal selges), etikettspråk eller CE-merke kan også nødvendiggjøre endringer av enhetsidentifikatoren.
Før UDI-regelen, kunne en produsent av medisinsk utstyr ha merket et produkt med et bestemt delenummer. Distributøren ville endre dette delenummeret, og helsepersonell eller sykehus ville deretter endre det igjen. Med muligheten for at hver enhet kunne endre delenummeret før det nådde frem til pasienten, var det nesten umulig å spore produkter, håndtere tilbakekallinger, forhindre forfalskning eller nøyaktig bestille ny lagervare på en effektiv måte.
Relatert: Implementering av robuste sporbarhetsløsninger
I dag gis en standardisert og vedvarende identifikator, kalt en UDI, til hver enhet for å gi alle parter raskere og mer presis identifikasjon av enheten, noe som til syvende og sist reduserer antallet medisinske feil. Denne UDI-en er en alfanumerisk kode som inneholder to viktige dataelementer:
- En enhetsidentifikator
- En produktidentifikator
En enhetsidentifikator er en statisk etikett tilordnet en gitt enhet som oppgir etikettutstederen (vanligvis enhetsprodusenten) og det spesifikke modellnummeret til enheten. Til sammenligning inneholder en produksjonsidentifikator data som kan variere, og mye av dataene den kan inneholde er valgfrie. Disse kan inkludere parti- og batchkoder, serienumre, utløpsdatoer og produksjonsdatoer. Kort sagt kan de valgfrie dataene være alt en produsent eller etikettutsteder anser som nødvendig for å støtte enhetssporing.
Hver UDI-etikett må presentere denne informasjonen på to måter:
- Menneskelig lesbar fremstilling (ren tekst)
- Maskinlesbar fremstilling (lesbar med strekkode eller RFID-leser)
På steder hvor en enhet kan tilfredsstille flere medisinske bruksområder, må UDI-en merkes direkte på enheten, ikke på emballasjen. Regelen gjelder også for enheter som kan brukes flere ganger.
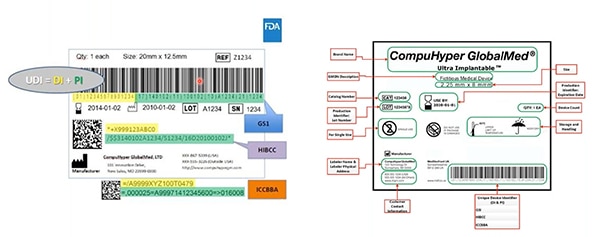 Figur 2: GS1, HIBCC og ICCBBA – UDI-utstedende byråer – opprette UDI-er; tilordne UDI-er tillatte symbologier; definere hvilke teknologier som kan samhandle med UDI-er; og angi den nødvendige kvaliteten på UDI-merker. Enhetsidentifikatoren er uthevet i gult på denne prøven. Produktidentifikatoren er uthevet i grønt. Andre elementer inkluderer informasjon som kan leses av mennesker, og som også er kodet inn i den maskinlesbare strekkoden. (Bildekilde: FDA)
Figur 2: GS1, HIBCC og ICCBBA – UDI-utstedende byråer – opprette UDI-er; tilordne UDI-er tillatte symbologier; definere hvilke teknologier som kan samhandle med UDI-er; og angi den nødvendige kvaliteten på UDI-merker. Enhetsidentifikatoren er uthevet i gult på denne prøven. Produktidentifikatoren er uthevet i grønt. Andre elementer inkluderer informasjon som kan leses av mennesker, og som også er kodet inn i den maskinlesbare strekkoden. (Bildekilde: FDA)
Alle enheter må registreres i den globale UDI-databasen for å muliggjøre sporing i tilfeller med tilbakekalling og for å gi offentligheten tilgang til informasjon om en gitt enhet. FDA-akkrediterte utstedende byråer er autorisert til å lage unike identifikatorer som enhetsprodusenter kan plassere på produktene sine.
Relaterte rapporter/utredninger Hold deg oppdatert om sporbarhet
UDI-skanningsteknologier og -teknikker
UDI-etiketter kan verifiseres på flere måter underveis, fra produksjon til bruk.
Rekkeverifisering (in-line) utføres av teknologier integrert i større maskiner som gir rask og nøyaktig behandling av et stort antall produkter etter hvert som de produseres. Disse teknologiene støttes av avansert programvare, og kommer ofte som etikettskrivere av industriell kvalitet. Disse skriverne er i stand til å utføre sin egen innebygde verifisering for å bekrefte at UDI-informasjonen er lesbar i henhold til strenge bransjestandarder, umiddelbart etter at den er opprettet på etikettproduksjonsstedet. For eksempel er Omron Automation V275-verifikatorer ment for bruk med termiske Zebra-skrivere for å samsvare med ISO 15426 og GS1-standardene til den utstedende autoriteten for FDA-samsvar.
Relatert: Omron Traceability Solutions
Andre steder kan rekkeverifisering se ut som spesialiserte flanketransportbånd med maskinsyn (machine vision flanking conveyors) på automatiserte produksjonslinjer, som inkluderer strekkodeavlesning for ekstremt rask og nøyaktig verifisering av UDI-merking på høymiksprodukter på produksjonslinjer med høy hastighet. Omron Automation MicroHAWK-tilbud utmerker seg på dette området, med avanserte sensorer supplert med en miniatyrisert konstruksjon og tilkoblingsmuligheter som inkluderer Ethernet/IP og PROFINET.
Relatert: Unngå erstatningsansvaret for feilmerking
Frakoblet UDI-verifisering er derimot den mest egnede for batchprøving av etiketter for å sikre kvalitet. Frakoblet verifisering blir ofte brukt til prøvetesting når medisinsk utstyr forlater eller ankommer et anlegg, og kan utfylle verifiseringssystemer på nett oppstrøms i distribusjonskjeden.
 Figur 3: UDI-er som er direkte merket på produkter, krever andre verifikatorer enn de som brukes for UDI-er som skrives ut på festede etiketter. (Bildekilde: Omron Automation)
Figur 3: UDI-er som er direkte merket på produkter, krever andre verifikatorer enn de som brukes for UDI-er som skrives ut på festede etiketter. (Bildekilde: Omron Automation)
Faktisk kan alle operasjoner for medisinsk distribusjon og helsetjeneste dra nytte av å bruke ISO-kompatible verifikatorer. Se på Omrons frakoblede UDI-verifiseringsprodukter i LVS 95XX-serien. Disse er i bruk:
- På lasermerkingsstasjoner og etikettskrivere der det opprettes koder
- Der koder brukes på produkter som kanskje ikke er atskilt fra kodeopprettelsesområdet
- I kvalitetskontrollstasjoner der maler, formatering og andre kodeelementer blir bekreftet
Spesifisere variasjoner av frakoblet UDI-verifisering
Den mest egnede frakoblede UDI-verifikatoren for et gitt bruksområde, avhenger av flere parametere.
Strekkodestørrelse: Store strekkoder er ofte enklere å skanne med identifikatorer som har et stort synsfelt definert av objektivets brennvidde og sensorstørrelsen. Se på Omron Automation sine LVS-9510 UDI-identifikatorer for skrivebord. Denne produktserien kan lese både lineære etiketter og 2D-etiketter. Fem forskjellige versjoner har forskjellig synsfelt, slik at konstruktører kan velge hvilken versjon som er kompatibel med størrelsen på strekkoden som må verifiseres. En nestefunksjon (stitching feature) muliggjør gradering av strekkoder som overskrider synsfeltet.
I tillegg kan alle LVS-9510-er automatisk fastsette symbolikken og blenderåpningen som trengs for å evaluere koden og identifisere og markere problemområder.
 Figur 4: Strekkodeverifisering som tilfredsstiller ISO-standarder, gjøres enklere med utstyr som kan verifisere både lineære (1D) og todimensjonale (2D) koder. Noe slikt utstyr fastsetter symbolikken og blenderåpningen som trengs for å evaluere koder og identifisere og markere problemer. LVS-9510 som vises her, har en nestefunksjon (stitching feature) som muliggjør gradering av strekkoder som er større enn synsfeltet. (Bildekilde: Omron Automation)
Figur 4: Strekkodeverifisering som tilfredsstiller ISO-standarder, gjøres enklere med utstyr som kan verifisere både lineære (1D) og todimensjonale (2D) koder. Noe slikt utstyr fastsetter symbolikken og blenderåpningen som trengs for å evaluere koder og identifisere og markere problemer. LVS-9510 som vises her, har en nestefunksjon (stitching feature) som muliggjør gradering av strekkoder som er større enn synsfeltet. (Bildekilde: Omron Automation)
Strekkodetype: Skannere må lese strekkodeformater som tildelt av de utstedende organene kjent som HIBCC, ICCBBA eller (oftest fra 2023) GS1. GS1 dikterer størrelsen, formatet og oppløsningen til UPC-er, lineære strekkoder og 2D-datamatrisestrekkoder.
UDI-merkeplassering: Se på den direkte delemerkingen (DPM – direct part marking) av medisinsk utstyr. Disse markeringene kan være utrolig små, spesielt når de identifiserer kirurgiske instrumenter og implanterbart medisinsk utstyr. For å lese og verifisere slike DPM UDI-er, har Omrons LVS-9580 og LVS-9585 håndholdte verifikatorer med ultrahøy tetthet et spesialobjektiv som kan gradere utallige DPM-er, inkludert de med cellestørrelser ned til 50,8 mm (0,002 tommer). Objektiver av industriell kvalitet på innsiden av LVS-9580 og LVS-9585, sikrer konsekvent lesenøyaktighet. De mest sofistikerte, er de svært kontrollerbare og kalibrerbare lysteknologiene inne i skannerne. Sammen med flere synsfelt, muliggjør belysningen umiddelbar optimalisering av de oppfangede UDI-bildene. Dette er spesielt viktig ettersom kodestandarden ikke kan utføre korreksjoner eller bildemanipuleringer etter oppfangingen.
Mer om UDI-skannerprogramvare
For å oppnå maksimal virkningsgrad må UDI-programvaren presentere diagnostisk informasjon i et intuitivt format for å støtte verifikatormaskinvare. Denne programvaren må klassifisere UDI-koder i henhold til ISO-definerte parametere (viktigst for å bekrefte lesbarheten) og bør ideelt sett også spore forverring av problemer over en serie UDI-skanninger.
Omron inkluderer all nødvendig programvare med hver eneste UDI-skanningsmaskinvare. Programvaren oppdateres jevnlig for å holde tritt med forskrifter i hyppig utvikling og ny bransjelovgivning.
En viktig funksjon i Omron-skannerprogramvaren, er håndteringen av kodesyntaks. Kort sagt må hver strekkode eller 2D-kode nøyaktig trekke ut all relevant informasjon, inkludert produkttype, partinummer, antall som er aktuelt, utløpsdato, fraktinformasjon osv. Resulterende datastrenger må formateres på en bestemt måte for å holde tritt med endrende krav, metoder og destinasjoner for medisinske produkter.
Regelmessig oppdatert programvare fra skannerprodusenten sikrer at sluttbrukerne holder seg oppdatert selv når nye koder utgis.
Konklusjon
Det amerikanske militæret hadde en gang som mål å fullt ut bruke et UID-produktsporingssystem som UDI-system for den medisinske industrien. Hensikten var å begrense det massive avfallet forbundet med tapte, dupliserte og utallige forsyninger på militære installasjoner, inkludert alt fra ferdige Raytheon-våpen til styringstavler levert av en liten avdeling for noen spesialiserte konstruksjoner. I dag opplever UID-er blandet bruk.
Det samme vil ikke skje med UDI-mandatet.
Mantraet som driver UDI-innføring er enkelt: Etiketten er produktet. En feil etikett kan tross alt forårsake en kjede av hendelser som kaster bort tiden til medisinsk personell og resulterer i at det medisinske utstyret blir kastet. Derfor må UDI-er vises på alle emballasjelag, for eksempel på enheten, pakken, bunten, kassen og lastepallen. UDI-er på sterilt medisinsk utstyr inne i steriliseringsforseglinger er spesielt viktige, ettersom det er uakseptabelt å bryte forseglingen for å verifisere enhetstypen.
Siden FDA krever full overholdelse av UDI-direktiver fra og med 24. september 2023, vil avanserte skanningsteknologier for verifisering av medisinske produkter bli avgjørende for automatiseringsprodusenter, samt maskinbyggere og sluttbrukerne de betjener.
Slike skannere kan tilfredsstille ekstremt spesifikke FDA UDI-krav for å bekrefte etiketter på et bredt spekter av laboratorieutstyr, medisinsk utstyr og klinisk diagnoseutstyr. Frakoblede strekkodeverifikatorer maksimerer sporbarhet, in-line-maskinsyn og avanserte DPM-lesere.

Disclaimer: The opinions, beliefs, and viewpoints expressed by the various authors and/or forum participants on this website do not necessarily reflect the opinions, beliefs, and viewpoints of DigiKey or official policies of DigiKey.









